
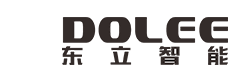


以往對抗體藥物的檢測主要是采用ELISA試劑盒完成,但ELISA方法存在開發時間長、準確性一般、假陽性率高、線性范圍窄等問題。而LC-MS/MS方法可以很好地彌補ELISA法的不足,但是如果前處理方法不夠成熟,面對復雜的基質組分,常導致選擇性和重現性不佳、檢測耗時或靈敏度不理想的情況。
01 技術原理
nSMOL技術同時彌補了ELISA法及傳統全酶解LC-MS/MS法的不足,技術原理如圖1所示,其利用胰酶納米顆粒與固化樹脂之間孔徑的差異,限制胰蛋白酶與抗體藥物的接觸區域,可以選擇性酶解Fab 區域特征肽段。
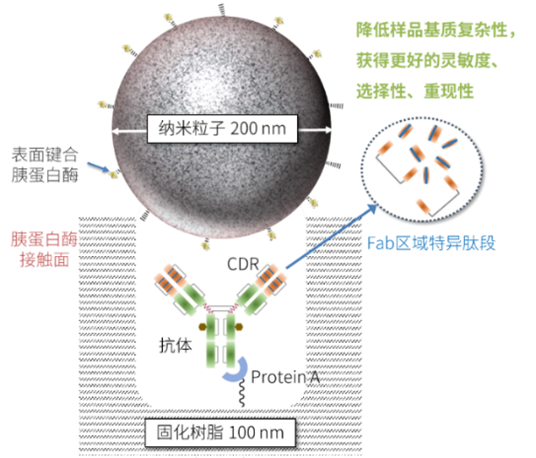
圖1. nSMOL技術選擇性酶解原理
摘自Iwamoto N. et. al.Analyst, 2014, 139, 576-580
02 技術優勢
nSMOL技術能確保獲得靶標蛋白特異性肽段,降低樣品的復雜程度,克服了傳統溶液全酶解技術中存在的酶解產物復雜、酶解效率低、酶解重現性差,內源性干擾嚴重等問題,從而表現出良好的選擇性和重現性。與ELISA法相比(見表1),其開發周期更短,定量特性更適合高靈敏、高特異性、多種抗體藥物的高通量測定。
03 應用廣闊
nSMOL技術開啟了抗體藥物定量分析的新視野,經過島津與客戶的不斷研究探索,該技術已在不同治療用途抗體藥物的研發、質控、臨床治療藥物監測中得到成熟應用。圖2展示了國內外相關應用成果。截至目前,全球已上市100余種抗體類藥物,nSMOL技術應用前景十分廣闊。
圖2. 國內外相關應用
臨床上多種抗體藥物均可用于炎癥性免疫疾病的治療,因此同時定量監測人血液中多種抗體藥物濃度的分析方法,具有迫切的臨床需求。
01 nSMOL臨床應用
nSMOL技術發明人 - 島津生命科學研究中心Takashi Shimada博士及其科研團隊,2019年在《Journal of Immunological Methods》期刊上發表文章,使用nSMOL技術開發了9種抗體和Fc-融合蛋白(英夫利昔單抗、阿達木單抗、尤特克單抗、戈利木單抗、依庫珠單抗、依那西普和阿巴西普、托珠單抗和美泊利單抗)的LC-MS生物分析方法,通過臨床試驗進一步論證了該技術在多種抗體藥物濃度同時監測應用中的巨大價值。
該文章中樣品的處理方式采用了改進的nSMOL反應條件, 如圖3所示。
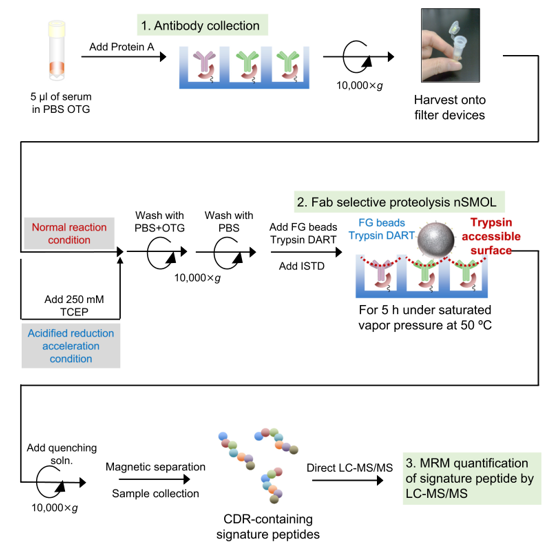
圖3. 9種抗體和Fc-融合蛋白的nSMOL樣本處理流程
首先樣品在緩沖液中與結合有Protein A的樹脂混合,樣品中的抗體被親和富集。其次,富集后的樹脂與含固定化胰酶納米顆粒混合,其表面固化的胰蛋白酶可以與樹脂所富集抗體的Fab區域進行充分接觸,特別是Fab區域中的CDR相關特征肽段被選擇性酶解下來,洗脫后進行LC-MS/MS定量。為提高低敏抗體托珠單抗和美泊利反應效率,采用了250 mM TCEP-HCl水溶液的酸化還原加速條件進行處理,得到了良好的結果。
9種抗體和Fc-融合蛋白通過特征肽段的LC-MS/MS檢測,獲得了其典型MRM色譜圖(圖4a,圖4b),9種藥物具有良好的靈敏度、色譜保留及峰形。
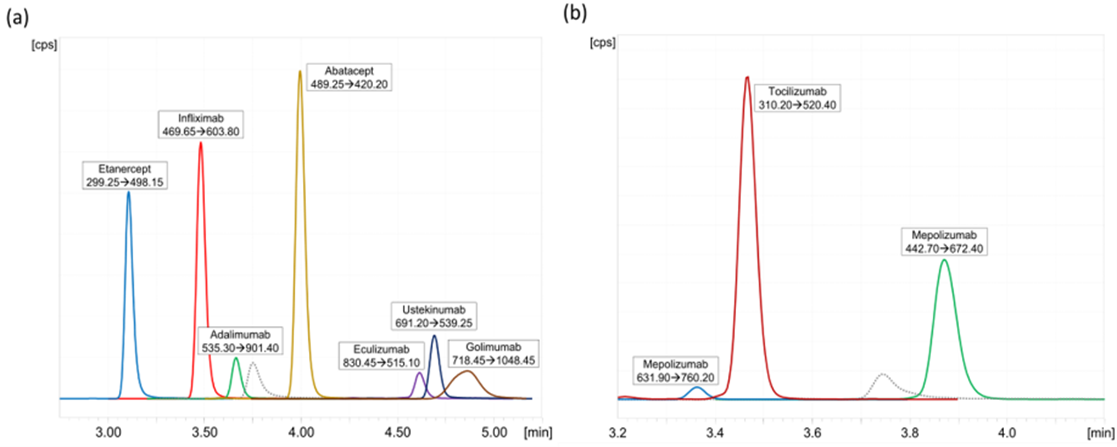
圖4. 9種抗體和Fc-融合蛋白藥物典型MRM色譜圖
根據日本厚生勞動省藥品和食品安全局評估和許可司發布的《藥物開發中生物分析方法驗證指南》進行了詳細驗證。驗證結果顯示該方案的定量靈敏度、線性范圍、重復性、準確性等指標均滿足該類抗體治療藥物監測需求。
02 臨床研究
2017年11月至2019年1月,京都大學醫院招募了45名患有類風濕關節炎(RA)或炎癥性腸病(IBD)的日本患者參加這項研究。作者使用臨床患者樣本對比分析了9種藥物同時監測與單個監測方法所得結果的相關性。部分結果見圖5。
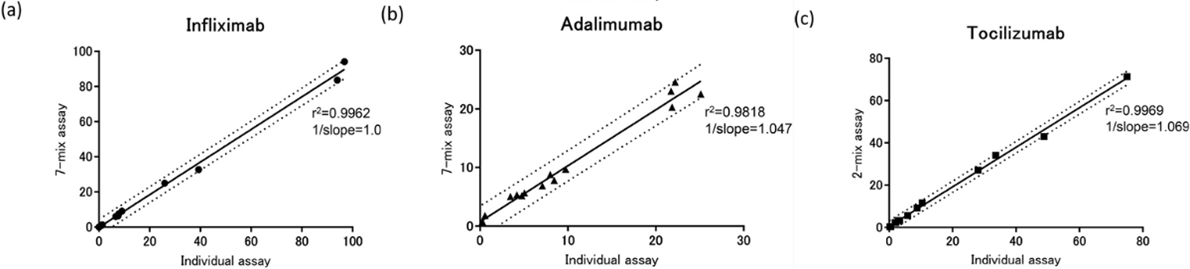
圖5. 兩種方法定量結果相關性分析
線性回歸擬合Pearson相關分析表明,兩種監測方法所得結果之間具有良好的相關性,且對照組各數據在95%置信區間內具有較高的重現性和較低的變異。
作者經過嚴苛的方法學驗證及臨床實驗,證明了基于nSMOL技術的LC-MS/MS法可以同時定量人血清中多種抗體及Fc-融合蛋白藥物,并應用于治療藥物監測,助力患者個體化精細用藥。
聲明:文章來源于島津中國,旨在分享若涉及版權問題,請及時與我司聯系,我們將快速處理。